От дълбока древност до деветнадесети век с понятието тумор се е обозначавала всяка подутина в организма, в това число бременността и подуването при възпаление. По-късно този термин започва да се употребява при подутина в резултат на новообразувание. При днешното развитие на медицината под тумор се разбира абнормна маса от клетки, които показват неконтролируема пролиферация, относителна автономност от регулационните системи на организма и прогресиращ растеж дори и след преустановяване на действието на факторите, които са ги предизвикали. Това разрастване на клетки по протичане и значение за организма рязко се отличава от реактивните клетъчни пролиферации при възпаление, хиперплазия, регенерация и други.
Биологичната същност на туморния процес се изразява с една своеобразна клетъчна пролиферация. Няма тумор без размножаване на новообразувани клетки. Туморните клетки произхождат от собствените клетки на организма. Всяка тъкан или клетъчна популация в човешкото тяло притежава потенциална възможност и може да доведе до формирането на туморен процес. Някои тъкани и клетки притежават по-високи капацитетни възможности за туморна трансформация и при тях туморите са по-чести. Според Рубин и Фабер само зрелите неврони и кардимиоцитите нямат такива възможности, но в днешно време дори и това твърдение не се приема безрезервно.
Въпросът за туморите в днешно време придобива голяма клинична и теоритична значимост поради високата заболяваемост и смъртност (особено от злокачествените варианти). Като причина за смъртността при човека туморите са на водещо място заедно със заболяванията на сърдечно – съдовата системи. По литературни данни 10 % от злокачествените тумори се развиват в лицево – челюстната област. В 5 – 6 % от случаите те са причина за общата ракова смъртност. В областта се диагностицират всички тумори, които могат да се развият в човешкия организъм (първични и метастатични), както и някои специфични само за тази локализация – одонтогенни, на слюнчените жлези, множествени базилиоми по окосмената част на главата (така наречените тюрбан форми).
Етиологията и патогенезата на туморите са все още недостатъчно изяснени. Етиологичните фактори се делят на екзо- и ендогенни, освен това на механични (хронични травми), физични (топлина, лъчеви), химични (тютюнопушене), електрохимични (патогалванизъм), биологични (вируси), хормонални, генетични и битово – климатични.
Онкогенът е ген, който е способен при определени условия да предизвика превръщането на нормалните клетки в туморни. Oбикновено онкогените представляват участъци с мутации по дължината на нормалните гени, които участъци са експресирани в много по-висока степен при туморните клетки. Всеки жив организъм съдържа в генома си подобни участъци, но това само по себе си не води до развитието на неопластичен процес. Онкогените блокират действието на нормалните гени, които принуждават клетката да загине (апоптоза). Така клетката не умира, а започва да се размножава неконтролирано и независимо от регулаторните системи на организма. Повечето онкогени се нуждаят от външен стимул, за да се проявят. Такива стимули могат да бъдат вирусни инфекции, мутации в друг ген, канцерогенни вещества и йонизиращи лъчения. От друга страна е възможно един нормален ген да се трансформира в онкоген чрез вграждането на допълнителни участъци от ДНК в него - точният механизъм за това е описан по-долу.
В човешкия геном се съдържат около 30 000 различни гени. Всеки от тези гени е част от ДНК и се открива във всяка клетка от живия организъм. Когато при определени гени се наблюдава генна експресия, клетката започва да произвежда определен вид протеини с определена биологична функция. Някои от тези белтъчни молекули служат за допълнителен начин за връзка между отделните клетки или дори само между отделните гени. Клетката използва специфични свои рецептори (и други методи) за да приеме посланието на протеините от другите клетки. Тези рецептори са създадени според съответния им ген в собствената им клетка.
Едно от най-значимите открития в областта на неопластичните процеси е че техните клетки имат мутации в специфични гени - споменатите вече онкогени и тумор супресорните гени. Още през 1979 година американските учени Харолд Вармус и Джордж Майкъл Бишъп откриват първият онкоген и печелят Нобелова награда за откритието си. Впоследствие са открити и много други онкогени. Както вече беше изяснено, онкогените участват в стимулирането и регулирането на клетъчния растеж. Когато те мутират, могат да са причина за развитието на различни видове тумори - бенигнени и малигнени. Нормално функциониращият онкоген без мутации се нарича протоонкоген, а мутиралият ген се нарича онкоген - като само последният тип ген предизвиква появата на тумор клинично. Нормалната функция на протоонкогена е да участва в клетъчната сигнализация. Това е процес при който клетката получава стимул за стартирането на митоза (деление) или апоптоза (програмирана клетъчна смърт). Протоонкогените са част от човешкия геном. От чисто дидактична гледна точка онкогените и тумор супресорните гени понякога се сравняват с автомобил. В раковите клетки първите действат като натиснат педал на газта, а нарушената изява на тумор супресорните гени - като повредени спирачки.
Преди известно време бяха открити точните механизми на канцерогенезата на гастро - интестиналния стромален тумор, поради което ще се спрем по-подробно върху тях. Всъщност трансформацията на нормалната клетка в неопластична протича по сходен начин при всички останали тумори в човешкия организъм, но далеч не при всеки вид неоплазма точните биохимични механизми са описани толкова подробно - това ще се случи в близкото бъдеще. При гастро - интестиналния стромален тумор доминантният онкоген е C-kit. Активираният КИТ (или в по-редки случаи подобният на него протеин PDGFRα - рецептор алфа на тромбоцитния растежен фактор) е основният клетъчен процес, който причинява развитието на въпросния тумор. Други онкогени, които имат отношение към ГИСТ са BRAF (рядко), KRAS и HRAS (и двата – още по-рядко).
Генът с-kit кодира инструкции за производството на протеина c-kit (KИT). Тази белтъчна молекула участва при сформирането на кръвоносните съдове, пигментацията на кожата, фертилитета и перисталтиката на червата. Една част от протеиновата молекула се намира от външната страна на клетъчната мембрана (екстрацелуларен домейн), а друга - от вътрешната (интрацелуларен домейн). Тези два домейна са разделени от клетъчната мембрана (трансмембранен домейн). В нормално функциониращата клетка друг протеин, наречен растежен фактор на стволовите клетки, се свързва към екстрацелуларната (извън клетката) част на рецептора и го активира чрез процес наречен фосфорилиране - жизненоважен процес в клетката, свързан с производството на енергия, необходима за протичането на всички процеси в нея. Така се стига до производството на белтъка КИТ. Активирането на рецептора за него води до подаване на по нататъшни сигнали за стимулиране на пролиферацията и оцеляването напред във времето на клетката. В здравата клетка тези процеси се стартират само и единствено когато организмът има необходимост от създаването на нови клетки - например при оздравяване на рани. В останалите случаи се формира патологично разрастване на тъканите, което може да бъде и злокачествено. Понякога тази пролиферация няма малигнен характер - например много цикатрикси разрастват допълнително и се превръщат в келоиди, но това все още дори не е неопластичен процес. В клетките на гастро-интестиналния стромален тумор се откриват в около 80 % от случаите мутации в c-kit гена. Когато този ген мутира, КИТ рецепторът не действа правилно.
Мутацията в молекулата на c-kit води до промени във формата и функцията му. Тя е причина за непрекъснатото активиране на рецептора и това е много важен факт за разбирането на механизмите на канцерогенезата. От този момент нататък дори и без наличието на растежния фактор на стволовите клетки КИТ рецепторите непрекъснато стимулират клетките на тумора да се делят и да не загиват. По този начин всички естествени процеси на клетката са нарушени – тя не загива както нормалните клетки и се възпроизвежда без организмът да има нужда от това. Това е причината в около 80 % от случаите за формирането и нарастването на описания неопластичен процес. Тумор супресорните гени участват в подтискането на клетъчния растеж. Някои мутации подтискат или дезактивират тумор-супресорните гени и по този начин също допринасят за развитието на неоплазии.
Някои икономисти с по-богато въображение правят аналогия между биологичното поведение на малигнения процес и държавната администрация. Ако се приеме че в един жив организъм нормалните метаболитни процеси осигуряват жизнената дейност и защитата от увреждащите фактори на околната среда, в една държава пък това се осигурява от бизнеса. Администрацията не генерира никаква добавена стойност и не произвежда нищо - при нормални условия и при липса на корупция и злоупотреби ползата от нея е нулева. В реалността положението е още по-лошо - държавните служители не само че се занимават с нищоправене и решават кръстословици по цял ден, но и в много случаи изнудват граждани и фирми за подкупи. Понякога се въвеждат и регулаторни промени в полза на едни и във вреда на други компании; не това обаче е основното относно аналогията между двете сфери. Важно е друго - администрацията има склонността да се размножава до безкрай, точно както постъпват неопластичните клетки. Назначават се нови и нови хора, на различни кухи позиции без всякакъв смисъл и функция, които единствено получават заплати и осигуровки. В даден момент това може да доведе до фалит на държавата - тъй като все някой трябва да произвежда стоки и услуги, а не само да консумира. По подобен начин малигненият процес води до смърт на организма - туморът не изпълнява никаква функция, той не изхранва или не защитава на тялото, а единствено консумира хранителни ресурси.

Схема на вирусната репликация - навлизане на вирусните частици в живата клетка. Поради важността на вирусите по отношение на канцерогенезата ще се спрем по-подробно върху начина на формиране на неопластични процеси като следствие на инфектирането с вируси. Поради пандемията от коронавирус интересът на учените към този вид живи организми нарастна многократно, въпреки че засега няма данни коронавирусът да участва в трансформацията на човешките клетки към какъвто и да било неопластичен процес.

Схема на синтеза на белтъчните молекули. Информацията се предава от ДНК към РНК, която достига до рибозомите и там се синтезират белтъчни молекули. Това няма голямо отношение към канцерогенезата - процесът на размножаване на клетките се регулира на ниво ДНК, а не на ниво белтък. Единствено в някои случаи като мултипления миелом синтезът на огромно количество протеинови молекули може да доведе до специфични клинични симптоми - така наречената амилоидоза, но колкото и да прдставлява специфичен клиничен белег, тя не е основното по отношение на трансформацията на нормалната клетка в туморна.
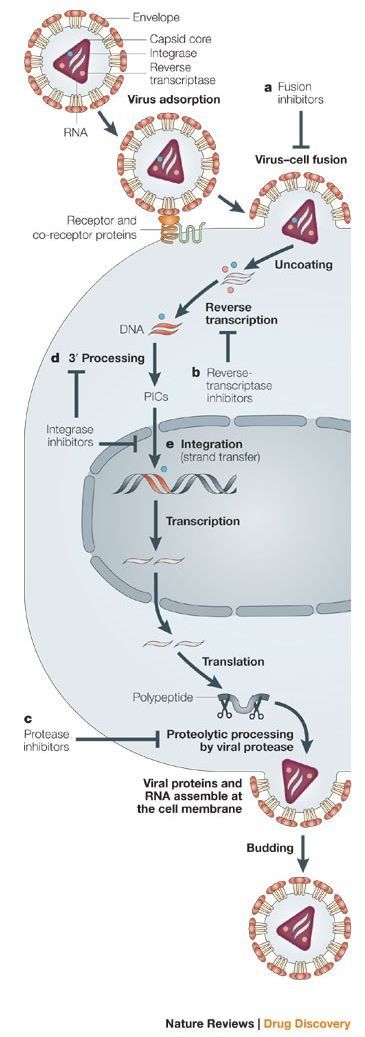
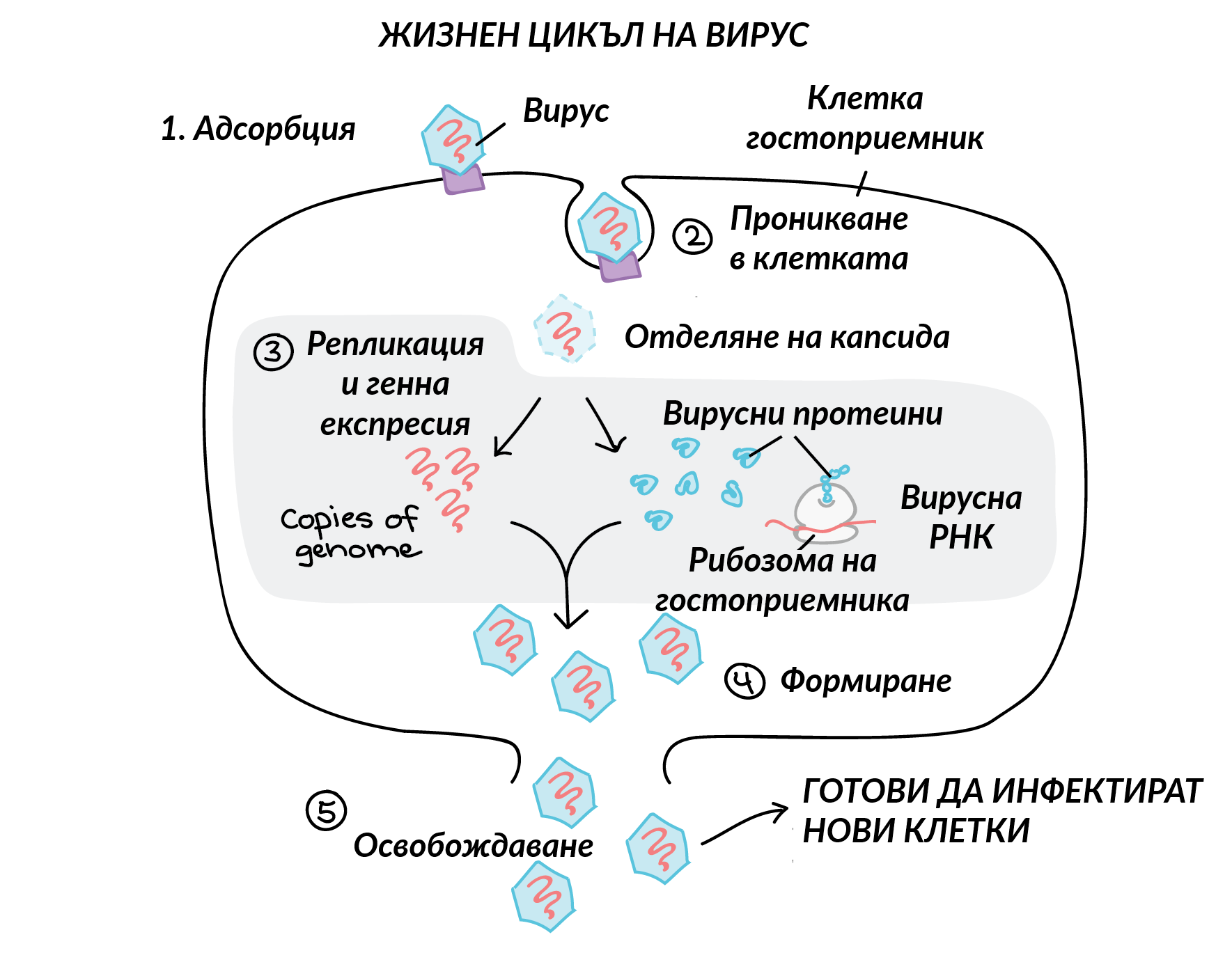
Процес на вирусната репликация - вирусът прониква в дадена клетка и започва да се размножава там. При това вирусът използва клетъчните органели за синтез на своите белтъци, тъй като не разполага със собствени такива - класически паразитизъм. В много случаи това води до разпад и унищожение на самата клетка, в други - само до излизане на вирусни частици извън мембраната (своеобразна вирусна секреция). В трети случаи има изключително дълъг латентен период - от порядъка на месеци и години. Вирусната нуклеинова киселина се вгражда в клетъчния геном и остава там в неактивно състояние.
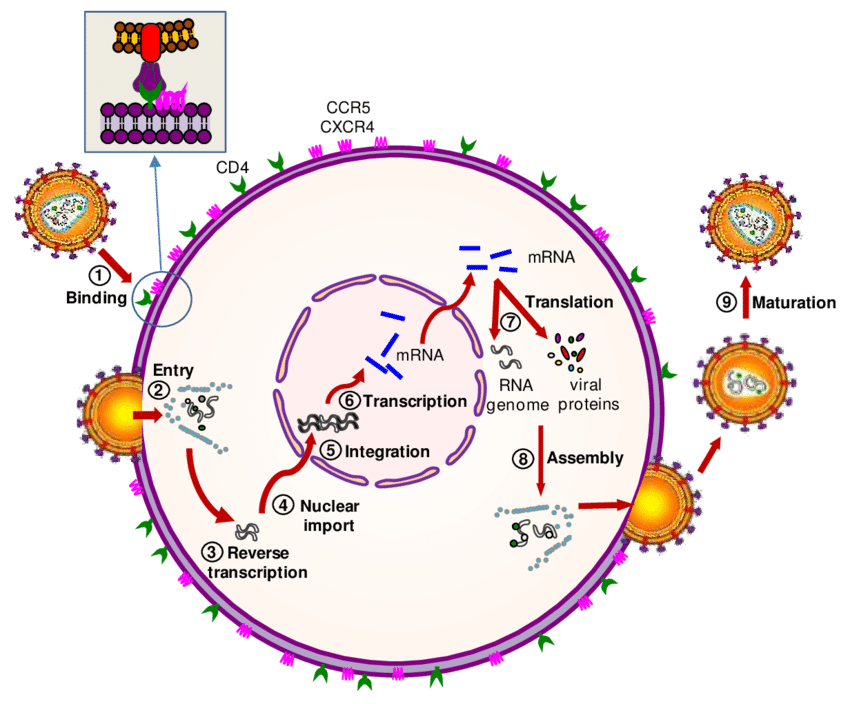
Друга схема на процеса на вирусната репликация. В този случай не настъпва клетъчна смърт или това поне не се случва веднага - клетката известно време функционира и секретира вирусни частици. Това обаче води до повишена консумация на хранителни вещества и в крайна сметка - до изтощаване на организма. Поради това много вирусни заболявания протичат с отпадналост и адинамия - тялото няма сила за изпълнение на ежедневната си активност.
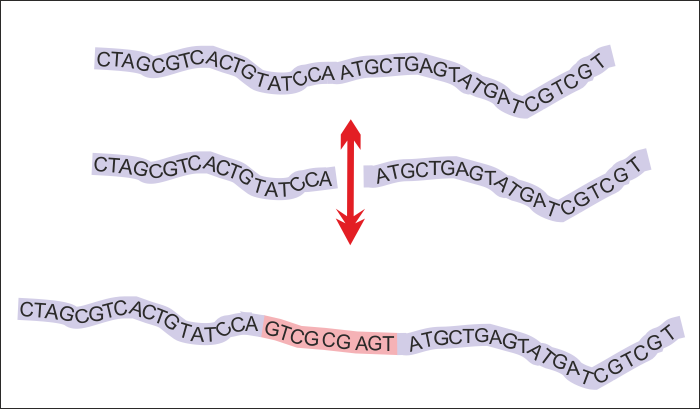
На пръв поглед вирусните инфекции нямат особена връзка с канцерогенезата, но... това е само на пръв поглед. На горната схема е показано подреждането на базите на ДНК в нормалния геном на човека. Начинът на тяхното подреждане осигурява съхраняването и предаването на генетичната информация. Проблемът е че по време на размножителния цикъл на вирусите тяхната собствена нуклеинова киселина се вгражда в ДНК на човешката клетка - което може да доведе до неочаквана промяна на закодирната информация. По този начин един нормален ген може да се превърне в онкоген - да започне да провокира неконтролируем растеж, което именно представлява неопластичната трансформация. Комбинацията на различните символи може да придобие неочаквано значение. Към настоящия момент на развитие на медицината има сигурни доказателства за онкогенното действие на човешкия папиломен вирус и на вируса на Епщайн - Бар.

Връзката между казармения хумор и генетиката. При грешки в информационния код се получават конфузни ситуации; и докато в едно свързочно поделение грешното разкодиране на последователността от точки, тирета и интервали може да доведе до това да получиш един зад врата, при генетиката това може да има опасни последици за целия организъм - развитие на малигнена неоплазма. В интерес на истината, промяната в информационния код при комуникацията във въоръжените сили също може да има ужасяващи последици или обратно, да доведе до спасението на хиляди човешки животи. Така например при отстъплението на турските войски от Пазарджик през зимата на 1878 година един арменец - телеграфист променя мястото на една запетайка и така спасява града от опожаряване. Турското командване подава телеграма с текст "Да се запази не, да се изгори!" Арменецът обаче променя текста на "Да се запази, не да се изгори!", при което гарнизонът на турската армия в Пазарджик се изтегля без нито една проява на насилие към местното население.
Международната класификация на болестите (МКБ), утвърдена от Световната Здравна Организация, класифицира туморните заболявания според техния тъканен произход, биологично поведение (доброкачествени и злокачествени), специфични органнотъканни особености и топографскоанатомична класификация. Най-общо туморите в лицево – челюстната област се разделят на първични и метастатични. Според хистологичния тип се срещат следните групи първични тумори
1. Епителни. Това са най-често срещаните неоплазии в лицево - челюстната област (90 %), а и в целия организъм изобщо. Произходът им е различен:
1.1 От покривния епител
1.1.1.Плоскоклетъчни Доброкачествени – папилом Злокачествени – спиноцелуларен карцином
1.1.2. Базалноклетъчни – те са само злокачествени – базоцелуларен карцином (нарича се още базилиом или базалноклетъчен епителиом)
1.2. От жлезистия епител
Доброкачествени – аденом, аденолимфом, цистаденом, плеоморфен аденом, онкоцитом
Злокачествени – малигнизирал плеоморфен аденом, цилиндром, аденокарцином, мукоепидермоиден карцином, ацинозноклетъчен карцином
1.3. От кожните анекси
1.3.1. От потните жлези
Доброкачествени – сирингоаденом
Злокачествени – сирингокарцином
1.3.2. От мастните жлези
Доброкачествени – мастен жлезист аденом
Злокачествени – мастен жлезист карцином
1.3.3. От космените фоликули
Доброкачествени – трихоепителиом
Злокачествени – трихоепителен карцином
2. Пигментни тумори – доброкачественият варианти тук са пигментният и непигментният (ахроматичен) невус, а злокачественият – малигненият меланом
3. Тумори с мезенхимен произход
3.1. Хемопоетични и лимфоретикуларни – тези тумори са само злокачествени. Тук спадат левкозите (миелоидни и лимфоидни) и лимфомите (ходжкинови и неходжкинови)
3.2. Съединителнотъканни
3.2.1. Фиброзна тъкан – доброкачествен вариант фибром, злокачествен – фибросарком
3.2.2. Мастна тъкан – доброкачествен вариант липом, злокачествен – липосарком
3.2.3. Костна тъкан – доброкачествен вариант остеом, злокачествен – остеосарком
3.2.4. Хрущялна тъкан – доброкачествен вариант хондром, злокачествен – хондросарком
3.3. Мускулна тъкан
3.3.1. Напречнонабраздена – доброкачествен вариант рабдомиом, злокачествен – рабдомиосарком
3.3.2. Гладкомускулна тъкан – доброкачествен вариант лейомиом, злокачествен – лейомиосарком
3.4. Съдови тумори
3.4.1. От кръвоносните съдове – доброкачествен вариант хемангиом, злокачествен – хемангиосарком
3.4.1. От лимфните съдове – доброкачествен вариант лимфангиом, злокачествен – лимфангиосарком
4. Тумори на нервната тъкан
4.1. Доброкачествени – неврилемом (шваном, неврином), неврофибром
4.2. Злокачествени – злокачествен неврином, неврофибросарком
5. Одонтогенни тумори – тук влизат голям брой неопластични процеси, специфични за лицево - челюстната област. Те са класифицирани от Kramer, Pindborg и Shear през 1992 г. Класификацията е утвърдена от СЗО и включва:
5.1. Доброкачествени тумори
5.1.1. Одонтогенен епител без мезенхим – амелобластом, плоскоклетъчен одонтогенен тумор, калцифициращ одонтогенен тумор (тумор на Pindborg), светлоклетъчен одонтогенен тумор
5.1.2. Одонтогенен епител с одонтогенен ектомезенхим, с или без твърдотъканни зъбни формирования – амелобластен фибром, дентином, одонтоамелобластом, калцифицираща киста, аденоматоиден одонтогенен тумор, сложно съставен одонтом, сложно смесен одонтом
5.1.3. Одонтогенен мезенхим с или без епител – одонтогенен фибром, одонтогенен миксом, циментом (циментобластом)
5.2. Злокачествени
5.2.1. Одонтогенни карциноми – злокачествен амелобластом, първичен вътрекостен карцином, злокачествени промени в одонтогенна киста
5.2.2. Одонтогенни саркоми – амелобластен фибросарком, амелобластен фибродентиносарком или фиброодонтосарком, одонтогенен карциносарком
6. Тумори с неясна и спорна генеза
6.1. Доброкачествени – миксом, фибромиксом, зърнистоклетъчен тумор, вроден миобластом
6.2. Злокачествени – миксосарком, фибромиксосарком, злокачествен зърнистоклетъчен тумор, сарком на Капоши, алвеоларен мекотъканен сарком
7. Некласифицируеми тумори
8. Тумороподобни състояния. Тук спадат голяма група заболявания, за които все още се спори дали спадат към туморите: обикновена брадавица, папиларна хиперплазия, доброкачествена лимфоепителиална лезия, слизеста киста, вродена фиброматоза, ксантогранулом, пиогенен гранулом, периферен гигантоклетъчен гранулом (епулис), травматичен неврином и неврофиброматоза.
Метастатичните (вторични) тумори в лицево - челюстната област са рядка патология – представляват 1 % от всички малигнени процеси в областта. Метастази в устната кухина и челюстните кости могат да дадат първични тумори на белия дроб, млечните жлези, яйчниците, тестисите, надбъбречните жлези, черния дроб, простатата, тибията, стомашно – чревния тракт. Метастазите могат да се локализират в гингивата, букалната и небната лигавица, езика, пода на устната кухина, челюстните кости. Най-често метастазите се локализират в долната челюст (95 %) и произхождат от карцинома на гърдата.
Съществува класификация на туморите според топографскоанатомичната им локализация. Според тази класификация туморите се развиват в следните области:
1. Кожа на лицето и устните
1.1. Горна устна, червена ивица
1.2. Долна устна, червена ивица
1.3. Устни ъгли (комисури)
2. Устна кухина
2.1. Лигавица – на устните, бузите, ретромоларните области, горен и долен букоалвеоларен сулкус
2.2. Гингива на горна челюст
2.3. Гингива на долна челюст
2.4. Небце
2.5. Език
2.5.1. Горна повърхност и странични ръбове пред papillae valatae (предните 2/3)
2.5.2. Долна повърхност
2.6. Под на устната кухина
В Световната Здравна Организация е приета и друга класификация на туморите – TNM – системата. Тя се основава на три елемента: Т – големината на първичния тумор, N – състоянието на регионерните лимфни възли, и М – наличието или липсата на далечни метастази. За прилагането на TNM – системата е необходимо туморът да бъде от епителен произход и да има поставена хистологична диагноза. Определянето на стадия в развитието на тумора става по следния начин:
Т – първичен тумор
Тis – преинвазивен карцином
Т0 – първичен тумор не се открива
Т1 – тумор с големина до 2 см. в най-големия си диаметър
Т2 – тумор от 2 до 4 см.
Т3 – тумор над 4 см.
Т4 – тумор, прорастващ в съседни структури – кост, мускули, съдове, кожа
Тх – не е възможно да се определи разпространението на първичния тумор
Тази класификация според Т – критерия е валидна най-вече при тумори на устната кухина. С известна специфика се отличават Т – критериите при тумори на слюнчените жлези и на максиларния синус. Това се дължи на по-специфичните топографско – анатомични особености на тези области. При карциноми на слюнчените жлези се използва следната класификация:
Тх – първичен тумор не може да се определи
Т0 – няма данни за първичен тумор
Т1 – тумор с размер до 2 см.
Т1а – тумор без локално разпространение
Т1в – с локално разпространение – инфилтрация в меки тъкани, кожа, кост или нерв
Т2 – тумор с размер от 2 до 4 см.
Т2а – без локално разпространение
Т2в – с локално разпространение
Т3 – тумор с размер от 4 до 6 см.
Т3а – без локално разпространение
Т3в – с локално разпространение
Т4 – тумор с размер над 6 см.
Т4а – без локално разпространение
Т4в – с локално разпространение
При карциноми на максиларните синуси се използва следната класификация:
Т0– първичен тумор не се наблюдава
Тis – carcinoma in situ
Т1 – тумор ограничен в синусната лигавица, без ерозия или деструкция на кост
Т2 – тумор с ерозия или деструкция на кост, включително твърдото небце и/или средния носен ход
Т3 – тумор инфилтриращ някоя от следните структури: кожата на бузите, задната стена на максиларния синус, пода на медиалната стена на орбитата, предния етмоидален синус
Т4 – тумор с инфилтрация на следните структури: орбита, lamina cribriformis, заден етмоидален и сфеноидален синуси, назофаринкс, твърдо небце (но при тотална деструкция и пенетрация в устната кухина), птеригомандибуларна или темпорална ямки, база на черепа
N – регионални лимфни възли
N0 – регионалните лимфни възли не са засегнати
N1 – метастаза в единичен подвижен лимфен възел едностранно хомолатерално с големина до 3 см.
N2А – метастаза в единичен хомолатерален лимфен възел с големина от 3 до 6 см. в най-голямото му измерение
N2B – метастаза в мултиплени хомолатерални лимфни възли с големина до 6 см. в най-голямото им измерение
N2C – метастази в билатерални или контралатерални лимфни възли с големина до 6 см.
N3 – метастаза в лимфен възел с големина над 6 см.
М – критерии за далечни метастази
М0 – далечни метастази не се откриват
М1 – откриват се далечни метастази
МХ – да се открият далечни метастази е невъзможно.
Въз основа на критериите Т, N и М се оценява стадият на тумора:
Стадий 0 – TisN0M0
Стадий I – T1N1M0
Стадий II – T2N0M0
Стадий III – T3N0M0, T1,2,3N1M0
Стадий IV – T4N0M0, T4N1M0, T1,2,3,4N2,3M0, T1,2,3,4N1,2,3M1
При тумори на слюнчените жлези наличието на в – индекс при Т – критерия класифицира тумора в един стадий по-напред в развитието му. Например тумор Т1аN0M0 е в I стадий, а Т1вN0M0 – във II стадий. При туморите на максиларните синуси стадирането според Т – критерия не се отличава от това при карциномите на устната кухина.
Диференциалната диагноза между доброкачествен и злокачествен тумор е най-важното решение, което патологът трябва да вземе при изследването на биопсичния материал. От това решение зависи методът на лечение на лезията и изходът от заболяването. Една погрешна преценка в това отношение може да има тежки последствия за здравето на пациента. Разделянето на туморите на доброкачествени и злокачествени е свързано главно с агресивността на процеса и възможността той да причини смъртта на пациента. Злокачествените тумори обикновено прогресират много бързо и оставени без лечение скоро водят до смъртта на пациента. Доброкачествените тумори, обратно, се проявяват само с локални промени, и много по-рядко водят до смъртта на пациента. Има, разбира се, и изключения - при интракраниална локализация дори и един бенигнен тумор бързо води до летален изход. Освен това доброкачествените тумори могат да притискат кръвоносни съдове, жлъчни канали, пикочни пътища и да предизвикват тежки функционални нарушения в засегнатите органи. От друга страна не винаги има строга корелация между морфологичните белези за малигненост и биологичното поведение на тумора.
Доброкачествените тумори имат бавен и дълготраен растеж - описан е случай на плеоморфен аденом, който се е развивал 66 години. Злокачествените тумори растат бързо и неудържимо. Доброкачествените растат експанзивно и притискат околните тъкани, а малигнените неоплазми растат инфилтративно и деструктивно с разрушаване на околните тъкани. Макроскопски бенигненият тумор изглежда капсулован и добре отграничен от околните тъкани, а малигненият е без капсула, като границите му с околните тъкани са неясни. Микроскопски при бенигнения тумор се откриват зрели, добре диференцирани клетки, а при малигнения - незрели, недиференцирани с клетъчен и структурен атипизъм. Бенигнените тумори обикновено имат бавно и дълготрайно развитие, а малигнените се развиват бързо. Някои карциноми могат да имат дълготрайно развитие и на даден етап изведнъж да започнат да нарастват по-бързо - при преход от високодиференциран към нискодиференциран вариант например. Повечето малигнени тумори обаче растат бързо от самото начало на развитието си. Бързо растящите малигнени тумори често показват исхемични некрози и кръвоизливи в централната си част, тъй като мрежата от кръвоносни съдове изостава в развитието си и не може да отговори на високите изисквания от кислород, необходими за голямата маса от новообразуваните клетки.
Доброкачествените тумори не рецидивират след оперативно отстраняване, а малигнените рецидивират и при това с всеки следващ рецидив растат все по-бързо и по-инфилтративно. От клинична гледна точка бенигнените тумори не дават общи прояви в организма, а имат предимно локален ефект; малигнените протичат с общи реакции - паранеопластичен синдром, интоксикация и кахексия. Най-важният диференциалнодиагностичен критерий обаче е метастазирането - доброкачествените тумори не метастазират, докато злокачествените дават метастази в лимфните възли и в далечни органи.
Значителна част от доброкачествените тумори имат потенциална малигненост и често се превръщат в злокачествени, а други пък се определят като тумори с граична малигненост. В тези случаи от особено значение е субективната преценка на патолога и неговата професионална подготовка и опит.
Пролиферативен център на тумора. В самото начало на туморната трансформация и растеж съществува само един център на развитие. На по-късен етап е възможно процесът да се развива мултицентрично, което се среща дори при някои доброкачествени процеси като плеоморфният аденом и амелобластомът. Първоначалното възникване обаче винаги е от една клетка - т.е. всички туморни процеси имат моноклонален характер. Вторично може да се образуват още няколко пролиферативни центъра, като не във всеки случай може да се определи кой е първичният, където първоначално се е случила неопластичната трансформация. Обикновено това е пролиферативният център с най-голям размер.
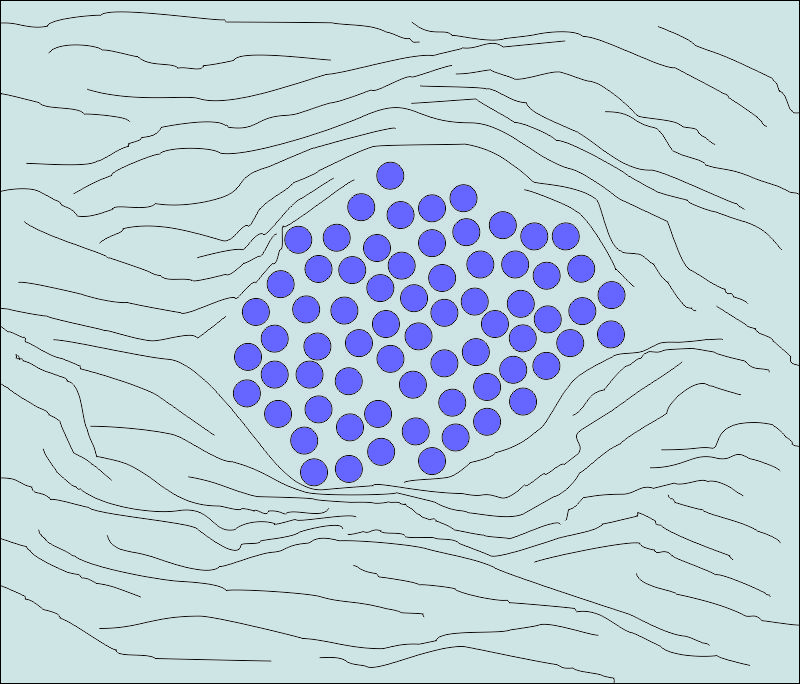
Начинът на растеж и взаимоотношенията с околните тъкани е доста различен при доброкачествените и злокачествените тумори. Доброкачествените тумори се характеризират с експанзивен растеж - както е показано на горната схема. Тяхната бавно нарастваща туморна маса притиска околните тъкани и органи и те постепенно атрофират. Паренхимните клетки на тумора не проникват в междуклетъчния матрикс и не разрушават клетъчните елементи. Следователно локалните промени при доброкачествените тумори имат предимно механичен характер, като изместват и притискат здравите тъкани - поради това и на горната схема съединителнотъканните влакна са показани сгъстени и деформирани.
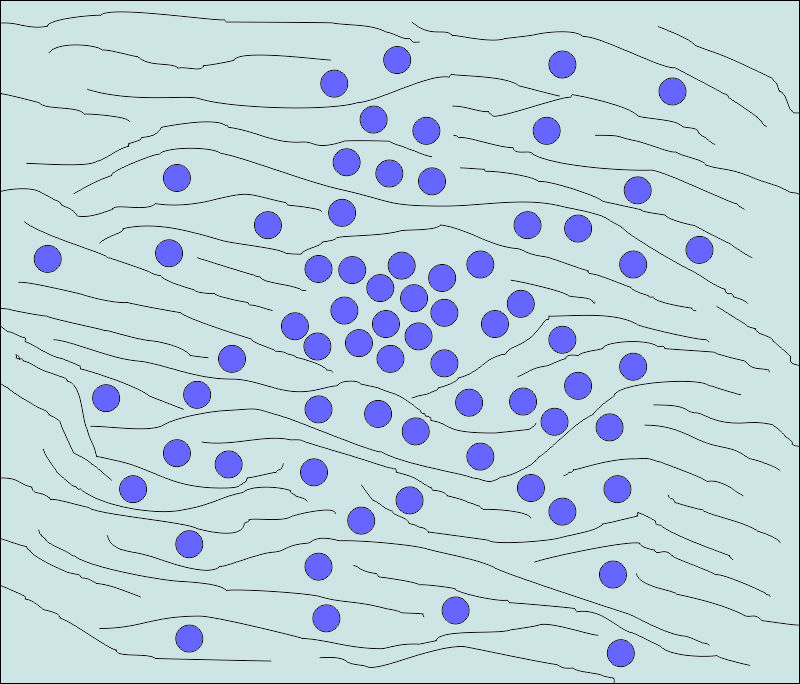
При злокачествените тумори това взаимодействие е различно и се характеризира с разрушаване на здравите околни тъкани и проникване на туморни клетки в техния междуклетъчен матрикс. Този начин на развитие се нарича инфилтративен и деструктивен растеж и е една от най-неблагоприятните характеристики на туморното развитие. Този тип растеж води до редица опасни усложнения - разязвяване на лигавицата на органите или пенетрация на кухи органи както се случва при стомашен или колоректален карцином. При напреднали случаи на карцином на маточната шийка инфилтрация може да се наблюдава към стената на вагината, пикочния мехур, уретерите и всички органи в малкия таз. Такъв начин на разпространение създава големи трудности, дори прави хирургичното лечение невъзможно - пациентът се определя като иноперабилен. Въпреки че през последните години реконструктивната хирургия се разви доста и разшири показанията за оперативни интервенции на тумори, в лицево - челюстната област също се срещат иноперабилни случаи - карциноми, инфилтриращи няколко анатомични зони като например под на устната кухина, буза, тялото на долната челюст и езика. Механизмът на инфилтративното и деструктивното развитие на злокачествените тумори не е напълно изяснен - съчетанието на няколко фактора определя това агресивно поведение. На първо място, при злокачествените тумори е нарушено сцеплението между отделните туморни клетки. То спомага за проникването на процес в околните тъкани. С този феномен се обяснява и десквамацията на туморните клетки в кухите органи като цервикалния карцином във вагиналния секрет, туморни клетки от бронхиален карцином в храчки или туморни клетки в урината при карцином на пикочните пътища. Всичко това се използва за цитологична диагностика на туморите.
Намалената кохезия между туморните клетки се обяснява с намалено калциево съдържание, което води до нарушение на между клетъчните контакти (десмозомите). Отбелязва се също така намалена биоелектрична активност на клетъчната повърхност и повишена продукция на сиаломуцини, което също нарушава междуклетъчните контакти. Крайният резултат от всички тези промени на туморно трансформираната клетка се проявява с намалена кохезия между отделните клетки. Това им позволява лесно да се отделят от пролиферативния туморен възел и да проникват в междуклетъчните пространства на околните здрави тъкани.
Загубата на контактна инхибиция е важен елемент от биологичните прояви на туморните клетки. Нормалните клетки съдържат клетъчни рецептори и електрохимични фактори, които подтискат митотичното деление на съседните клетки - именно това е контактната инхибиция и е съществен елемент от възможностите на организма за регенерация. Действието му е доказано в клетъчни култури - при тях клетки, които са в контакт със съседните, задържат пролиферацията си и обратно, свободните клетки показват активна пролиферация. За туморните клетки е установено че няма клетъчна инхибиция ин витро и няма съмнение че същият феномен е налице и при условия ин виво. Тази характеристика на туморните клетки обяснява усилената неконтролирана клетъчна пролиферация, както и нахлуването и разрушаването на околните нормални клетки и тъкани.
Освен това при лабораторни условия е установено че туморните клетки са по-подвижни от нормалните. При това положение придвижването на неопластичните клетки от пролиферативния център към околните здрави тъкани е по-бързо. Инвазирането в здравите тъкани се подпомага още повече от промените, предизвикани от фагоцитарната активност на макрофаги и сегемнтоядрени левкоцити.
Продукцията на ензими и други биологично активни вещества също има значение за биологичното поведение на злокачествените тумори. Според Рубин и Фабер този процес се осъществява в следната последователност: прилепване на туморните клетки към компоненти на съединителнотъканния матрикс, ензимно лизиране на тези структури и придвижване на клетките през така образуваните тъканни дефекти. Прилепването се получава при взаимодействие с матриксни компоненти като фибронектин, ламинин, протеогликани и колаген, които биват лизирани от протеази и колагенза, които се отделят от туморните клетки. Адхезията им се обяснява с наличието на специални ламининови рецептори върху мембраните им. Установено е че в туморните клетки на карцином на млечната жлеза повърхностният ламинин е пет пъти повече отколкото в нормална тъкан на млечна жлеза. Малигнените клетки се характеризират с по-висока колагеназна продукция, включително и IV тип колагеназа, която се смята за най-активна спрямо колагена на базалните мембрани. Чрез тези ензими туморните клетки лизират съединителнотъканните елементи, след което с амебовидни движения инфилтрират околните тъкани.
Отграничаването на туморите от здравите тъкани е друг много характерен белег за разликите между бенигнен и малигнен тумор. Доброкачествените тумори са оградени от съединителнотъканна капсула. Това позволява оперативното им отстраняване да се извърши лесно и ефективно. Образуването на капсула около различните патологични процеси е важен биологичен феномен и трябва да се разглежда като защитна реакция на организма. При доброкачествени тумори инкапсулацията се обяснява по два начина - бавното развитие на тумора и това че капсулата е продукт на стромата. По време на растежа си туморът притиска околните тъкани и предизвиква атрофия на нормалните паренхимни клетки на органите. При това положение по-резистентната паренхимна съставка или стромата на органите остава под формата на обвивка около тумората маса. В голяма част от туморите е установено че растежът предизвиква фиброзна реакция в съседните тъкани - процес, известен като десмоплазия. Такава реакция се среща и при много злокачествени тумори, което обяснява и наличието на капсула при много от тях; все пак бавното развитие на доброкачествения тумор води до натрупването на здрава, плътна и фиброзна тъкан около периферията му. При малигнените тумори капсулата е много по-тънка, разязвена и в много участъци перфорирана от неопластичния процес. Туморните клетки я разрушват и пенетрират в околните тъкани по механизмите, описани по-горе. В преценката за малигненост на туморите инфилтрацията от неопластични клетки в капсулата е много съществен критерий.
Липсата на капсула не бива да се приема винаги като критерий за малигненост. По-съществено е да се прецени дали има рязка граница между туморната и околната здрава тъкан. Някои тумори като лейомиома на матката, който е напълно доброкачествен, обикновено не образуват капсула, но са заобиколени от силно компримиран миометриум, поради което лесно се отстраняват по оперативен път. Неясно оформена капсула има и при някои съдови тумори - хемангиом и лимфангиом, но те са напълно доброкачествени. От това следва че преценката за характера на тумора не бва да се прави само въз основа на един морфологичен белег.
Диференциацията е един от най-съществените морфологични критерии за малигненост на туморите. С термина диференциация се означава степента на морфологичната прилика в сравнение със съответните нормални клетки. Доброкачествените тумори се разрастват от зрели, добре диференцирани клетки и структури, които не се отличават съществено по морфология от нормалните клетки и тъкани. Така например аденомът на щитовидната жлеза е съставен от фоликули, тапицирани от фоликуларни клетки и изпълнени с колоид както при нормалната щитовидна жлеза. Доброкачествените мезенхимни тумори като фибром, липом, лейомиом, остеом са съставени от зрели клетки и изглеждат като съответните нормални тъкани. Разграничаването им от нормалните тъкани се базира на неправилното подреждане на клетките и нарушеното съотношение между отделните клетки. Тази особеност се определя като дисполаритет, а променената структурна организация на съответните тъкани като тъканен атипизъм.
Злокачествените тумори са недиференцирани - те се отличават значително от нормалните тъкани, до толкова голяма степен, че в някои случаи е невъзможно да се определи хистогенезата на тумора. В литературата се употребява и терминът дедиференциация, тъй като се счита че всички тумори разрастват от зрели, добре диференцирани и зрели клетъчни популации. Сега това схващане донякъде е загубило своята актуалност - приема се че туморните клетки водят началото си от недиференцирани стволови или резервни клетки и се касае за задържане на диференциацията, а не за дедиференциация. Като синоним на нарушената диференциация се използва и терминът анаплазия, което етимологично означава обратно или липсващо образуване, но това се покрива с разбирането за клетъчен атипизъм. Степента на диференциация или анаплазия на туморите може да бъде различно изразена. Сега е възприето да се различават три степени на диференциация - висока, умерена и ниска. Колкото по-ниска е степента на диференциация на даден злокачествен тумор, толкова по-агресивен е той и толкова по-неблагоприятна е неговата прогноза. Освен нарушената структурна организация на органите и тъканите, морфологичните белези за незрялост на туморите се определят от степента на техния клетъчен атипизъм. Повече информация за патоморфологичните белези на туморите прочетете тук...
Освен клетъчния атипизъм при нискодиференцираните малигнени тумори е нарушена тъканната архитектура. Тази особеност е много добре изразена при жлезисти органи, където гландуларният строеж е напълно заличен, а туморният паренхим разраства под формата на гнезда или повлекла от туморни клетки с неправилно подреждане. Съединителнотъканната строма е различно представена и хаотично разрастнала.
Доброкачествените тумори обикновено не рецидивират след радикалното си отстраняване. Обратно, злокачествените винаги имат склонност към рецидив след проведено оперативно или друг тип лечение. Тази биологична проява на тумора може да се обясни по два начина - в някои случаи дори и след преустановяване на действието на етиологичните фактори и след пълното премахване на туморния възел неопластичната трансформация продължава и в околните здрави тъкани. В повечето случаи обаче рецидивите се обясняват с непълното екстирпиране на туморния възел поради неясната граница между здравата и туморно променената тъкан, обусловено от инфилтративния растеж. Останалите макар и единични клетки служат като пролиферативен център за ново разрастване. С това може да се обясни обстоятелството че някои доброкачествени тумори като плеоморфния аденом на слюнчените жлези също могат да рецидивират - някои плеоморфни аденоми растат мултицентирчно въпреки бенигнения им характер и изискват радикална консервативна паротидектомия. Някои одонтогенни тумори като амелобластомите също растат локално инфилтративно и изискват по-радикален подход; ето защо склонността към рецидиви на злокачествените тумори не бива да се приема като абсолютен критерий за малигненост. Той трябва да се разглежда винаги в комбинация с останалите признаци за злокачественост.
Общите реакции в организма на тумороносителя се различават при доброкачествените и злокачествените тумори. За бенигнените неоплазми са характерни предимно локалните промени, обусловени от локалния натиск. Злокачествените тумори в повечето случаи дават общи реакции, които се изразяват най-често със загуба на апетит, общо неразположение, кървене от някои кухи органи и други. В резултат на това пациентите отслабват на тегло с първоначално изчерпване на мстните депа, след което се стига до тежко изтощение. Освен това се появяват общи симптоми, несвързани пряко с инфилтративния растеж на туморитеи метастазите, известни като паранеопластичен синдром. Тези симптоми в много случаи се явяват като първа и най-ранна манифестация на злокачествените тумори.
Метастазирането на туморите е една от най-манифестните и категорични прояви, по които се разграничават бенигнените от малигнените неоплазми. Доброкачествените тумори не метастазират, докато всички злокачествени тумори с изключение на базоцелуларния карцином на кожата и малигнените глиални тумори имат потенциална възможност да метастазират. Базоцелуларният карцином също може да метастазира, но на много късен етап от своето развитие и след многократни рецидиви. Метастазата е биологичен феномен - туморните клетки инвазират кръвоносните и лимфните съдове, като се откъсват от първичния възел и се придвижват в циркулационното русло под формата на клетъчни емболи. Когато клетките заседнат в някой орган, те пенетрират в обратен ред съдовата стена и започват автономен растеж на новото място. Възникналите нови туморни огнища запазват хистологичния строеж на първичния тумор, но имат тенденция към по-ниска степен на диференциация. В много случаи е възможно да се определи първичното огнище само по хистологичния изглед на метастазата, но далеч не и във всеки един случай - понякога заключението на патолога е "Неизвестно първично огнище".
Механизмът на метастазирането е подобен на този, описан при инфилтрацията на туморите в околните тъкани, но повторното разрастване е далеч от първичната лезия. Основният пусков момент е преодоляването на съпротивата на базалните мембрани на тъканите и на кръвоносните съдове. Този процес се осъществява в три стадия, както вече беше описано - прилепване на туморните клетки до базалните мембрани и матриксните компоненти, лизиране на тези структури и преминаване на туморните клетки през тези лизирани участъци. Прилепването се осъществява благодарение на ламининовите рецептори върху мембраната на туморните клетки. Освен това те продуцират колагеназа тип 4, която лизира спецаилно колагена от базалните мебрани на кръвоносните и лимфните съдове. След това преминаването на неопластичните клетки в съдовете е вече лесно. Последващото придвижване и засядане в различни органи и системи се определя от органната и съдовата архитектоника. Голяма част от туморните клетки, попаднали в съдовете, загиват под въздействие на различните защитни системи на организма. Една малка част от тях обаче остава и пенетрира в обратен ред от ендотелните клетки през базалните мембрани към периваскуларния клетъчен матрикс, където отново започва една неконтролирана автономна клетъчна пролиферация. Възможностите за метастатичен растеж на туморите са зависими от много фактори, но от основно значение е не толкова обилното кръвоснабдяване на органа, колкото биологичното поведение на тумора и неговата агресивност. С това може да се обясни защо толкова богато кръвоснабдени органи като слезката и напречнонабраздената мускулатура почти никога или рядко са място за метастази.
Описани са три начина на метастазиране - лимфни, кръвни и имплантационни метастази. Злокачествените епителни тумори метастазират основно по лимфен път, а мезенхимните - по хематогенен път. Напоследък тези становища се отхвърлят. Начинът на метастазиране се определя от анатомичните особености на органите и тъканите и от биологичното поведение на самия тумор. Предимно лимфното разпространение на карцинома на млечната жлеза например се определя от богатата лимфна мрежа на органа. Освен това базалната мембрана, която е една от бариерите против туморното разпространение, е развита само в големите лимфни съдове, докато в лимфните капиляри такава липсва. С това може да се обясни защо туморните клетки пенетрират по-често в лимфните пътища, а не в кръвоносните съдове. След като попаднат в лимфните капиляри, туморните клетки се транспортират до регионалните лимфни възли, където попадат първоначално в маргиналния синус и там започва новият туморен растеж. Тази пролиферация води до увеличаване на размера на лимфните възли - понякога те стават по-големи дори от първичното огнище. Метастазите в регионерните лимфни възли са важен прогностичен белег и затова винаги трябва да се изследват не само клинично, но и хистологично. При това е важно да се знае че лимфните възли, в които се събира лимфата от сътоветната област, могат да бъдат уголемени и без наличието на метастази в тях - като проява на локална възпалителна реакция и реактивна хиперплазия. Промените в тези случаи се обозначават като синусна хистиоцитоза (един не много точен термин) и са резултат от антигенна стимулация от клетъчен детрит от некротични туморни клетки. Следователно клинично уголемените лимфни възли не бива да се възприемат като синоним на метастази - за такива следва да се говори едва след хистологично верифициране на премахнатия лимфен възел.
Лимфни метастази могат да се открият и в далечни лимфни възли - не само в регионалния лимфен басейн около анатомичната локализация на тумора. Те се наричат прескачащи метастази и могат да бъдат първичен сигнал за наличие на туморен процес. Такъв характер има така наречената жлеза на Вирхов - метастаза на стомашен карцином в супраклавикуларен лимфен възел. В миналото тази метастаза се е смятала за важен диагностичен белег.
Хематогенните метастази доскоро се смятаха за характерни предимно за мезенхимните тумори. За много злокачествени тумори от епителен произход като бъбречния и простатния карцином обаче също са храктерни метастазите по кръвен път. Туморните клетки инвазират в капилярите и венулите, тъй като артериите и артериолите с ас по-дебела и съответно по-резистентна съдова стена. С това може да се обясни и защо черният и белият дроб са най-честото място за развитие на хематогенни метастази. Абдоминалните тумори инвазират най-често в разклоненията на порталната система и туморните клетки попадат в черния дроб, който се явява първата бариера за тяхното придвижване. В останалите органи туморната инвазия е в разклоненията на венозните съдове, след което неопластичните клетки се придвижват по хода на двете кухи вени и засядат в белите дробове. В някои случаи тези две бариери се преодоляват и туморните клетки могат да попаднат и в други органи. Освен това туморни клетки проникват и в артериалната система (при преминаване през белия дроб), след което могат да попаднат в различни органи. Също така клетките могат да преминат през черния дроб и да попаднат в белия дроб или пък след преминаването на белия дроб да попаднат в мозъка. Заседналите в микроциркулацията туморни клетки пенетрират по обратен път съдовата стена и дават началото на нов туморен възел. Освен в мозъка, много чести са метастазите в костите, което вероятно се дължи на особености на съдовата система в тези органи.
С термина имплантационни метастази се означава разпространението на тумора в различни телесни кухини - перитонеална, плеврална, перикардиална, както и субарахноидалното пространство на мозъка. Това се случва предимно при епителни тумори и се нарича карциноматоза на перитонеума, плеврата или перикарда. Това е лош прогностичен белег и обикновено е на късен етап от развитието на туморния процес. Развитието на имплантационните метастази е много бързо и е резултат от пенетрацията на туморните клетки през съединителнотъканната основа и мезотелните клетки на серозните повърхности. В основата на тази пенетрация лежат същите биологични прояви на туморните клетки. Типичен пример за такъв тип метастази е карциномът на яйчниците, който има трансперитонеално развитие, като се разпространява по серозните повърхности на черния дроб и останалите коремни органи.
Цитологичните и хистологични белези на тумора са до голяма степен субективни или полуколичествени и се основават на степента на анаплазия и броя на пролифериралите клетки. Анаплазията се определя от формата, големината и начина на подреждане не клетките, както и от функционалната активност на различни органни структури като жлезисти и жлезистоподобни формации при аденокарциномите или кератинообразуване под формата на ракови перли при сквамозния карцином. Проявите на бързо развитие на тумора се определят от наличието на атипични митози, ядрен плеоморфизъм и гигантски туморни клетки. Въз основа на тези критерии е прието туморите да се разделят на три степени на малигненост - означават се с римските цифри от I до III и означават съответно добре(високо), умерено или нискодиференциран тумор. Общоприето е становището че нискодиференцираните тумори са по-агресивни от умерено и високодиференцираните. Тези морфологични белези не бива да се абсолютизират, тъй като в различни участъци на един и същи тумор белезите на диференциация може да се различават, а степента на анаплазия се променя в хода на туморното разрастване и особено при вторичното развитие на метастатични тумори.
Цитологичното степенуване на малигнеността на туморите на лимфната тъкан, каквито са Ходжкиновите и Неходжкиновите лимфоми, се определя чрез класифицирането им в различни хистологични и цитологични варианти. За някои от тях патологът трябва допълнително да посочи дали са с ниска или висока степен на малигненост.
Клиничните и експерименталните проучвания на туморите показват че повечето тумори започват своето развитие от отделна туморно трансформирана клетка - налице е мноклонален произход. Тази теория е възприета основно във връзка с пролиферативните процеси на хемопоетичния апарат. Най-съществено доказателство за това е продукцията на строго определен имуноглобулин от неопластични плазматични клетки при болни с мултиплен миелом. В подкрепа на моноклоналния произход на туморите се приема и разпределението на глюкозо-6-фосфат-дехидрогеназата у жени, които са хетерозиготни по отношение на изоензим А и В. Те са кодирани в генните участъци на Х-хромозомата, но само един от тези гени се проявява в отделната клетка. Въпреки че генотипът на отделните клетки е един и същ, фенотипът им се променя по отношение на експресията на А или В изоензим. Проучванията на лейомиома на матката показват че гладкомускулните клетки, от които е съставен туморът, в отделните си участъци съдържат или само А, или само В изоензим, което се приема за доказателство че тези клетки произхождат само от една клетъчна линия. За това говори и наличието на специфични клетъчни рецептори, въз основа на които с имунохистохимични методи може да се определи хистогенезата на клетките. Такива изследвания намират много голямо приложение при биопсия на лимфни възли и типизиране на малигнени лимфоми.
Независимо от моноклоналния произход туморите показват и значителни генетични нарушения в хода на тяхното развитие. Неопластичните клетки са по-чувствителни и в тях по-често възникват хромозомни аномалии, което стои в основата на туморната прогресия в посока по-малигнен хистологичен тип. В много редки случаи може да се открие поликлоналност на туморите. Такъв характер има неврофибромът, който е съставен от два типа клетки с различен произход.
Голяма част от проучванията в областта на онкологията се извършват върху клетъчни култури. Това даде възможност да се изяснят различни биохимични и биологични особености на туморната клетка. Пролиферацията на туморната клетка в клетъчни култури обаче се различава от аналогичния процес в организма, поради което тези особености трябва да се познават и да се интерпретират правилно. Различията между клетъчните култури и туморите в живия организъм се свеждат до някои специфични белези - на първо място в отпадане на контрола върху растежа. За разлика от нормалните клетки трансформираните клетки в култури нямат контактни инхибитори и поради това са по-слабо чувствителни към тези фактори. Понякога малигнените клетки са под формата на неправилни струпвания. Редуцират се серумните растежни фактори - трансформираните туморни клетки изискват по-ниска серумна концентрация, тъй като са с намалени възможности за продукция на серумни растежни фактори. Налице е зависимост от средата - почти всички клетки разрастват в полусолидни среди, какъвто е агарът. Всички лабораторни клетъчни култури могат да се трансплантират в организма на животни и да послужат като началото на туморно разрастване (трансплантабилност). Редуцирана е кохезията между клетките поради редукция на повърхностните гликопротеини, какъвто е фибронектинът.